Utente:Grasso Luigi/sanbox1/Riordinamento Fries
Il riarrangiamento di Fries o reazione di Fries, che prende il nome dal chimico tedesco Karl Theophil Fries, è una reazione di riarrangiamento di un estere fenolico a un idrossi arile chetone tramite catalisi di un acido di Lewis.[1][2][3][4]

Implica la migrazione di un gruppo acile di un estere fenolico nell'anello arile. La reazione è orto e para selettiva e uno dei due prodotti si ottiene cambiando le condizioni di reazione, come la temperatura e il solvente. La reazione usa catalizzatori acidi di Brønsted o di Lewis come HF, AlCl3, BF3,TiCl4 o SnCl4. Gli acidi sono usati in eccesso rispetto alla quantità stechiometrica, sopratutto gli acidi di Lewis, poiché formano complessi sia con i materiali di partenza che con i prodotti.
Meccanismo della reazione
[modifica | modifica wikitesto]Nonostante molti sforzi, un definitivo meccanismo di reazione per il riarrangiamento di Fries non è stato determinato. Evidenze per meccanismi inter- e intramolecolare si sono avute con esperimenti crossover con reagenti misti. Il progresso della reazione non dipende dal solvente o dal substrato. Un meccanismo ampiamente accettato comporta un intermedio carbocatione.
Nella prima fase di reazione un acido di Lewis ad esempio cloruro d'alluminio (AlCl3) coordina l'atomo di ossigeno del gruppo acile a quello carbonile. Questo atomo di ossigeno è più ricco di elettroni rispetto a quello fenolico ed è la base di Lewis preferita. This interaction polarizes the bond between the acyl residue and the phenolic oxygen atom and the aluminium chloride group rearranges to the phenolic oxygen atom. This generates a free acylium carbocation which reacts in a classical electrophilic aromatic substitution with the aromatic ring. The abstracted proton is released as hydrochloric acid where the chlorine is derived from aluminium chloride.

L'orientamento della reazione di sostituzione dipende dalla temperatura. Una temperatura di reazione bassa favorisce la sostituzione para e a temperatura alta prevale il prodotto orto, questo può essere razionalizzato esibendo il classico controllo cinetico e controllo termodinamico come il prodotto orto può formare un più stabile complesso bidentato con l'alluminio. [5]
Sostituzione para (temperatura bassa):

Sostituzione orto (temperatura alta):

La formazione del prodotto orto è favorita pure nei solventi non-polari; all'aumentare della polarità del solvente, il rapporto del prodotto para aumenta pure.[6]
Applicazioni
[modifica | modifica wikitesto]I fenoli reagiscono per formare gli esteri invece degli idrossiarilchetoni quando reagiscono con gli alogenuri acilici sotto le condizioni dell'acilazione di Friedel-Crafts. Quindi, tale reazione è importante nell'industria per la sintesi degli idrossiarilchetoni, che sono intermedi importanti per diversi prodotti farmaceutici. In alternativa al cloruro d'alluminio, si possono utilizzare altri acidi di Lewis come il trifluoruro di boro e il triflato di bismuto o acidi protici forti come il fluoruro di idrogeno e l'acido metansolfonico. Proprio per evitare l'uso di queste ricerche corrosive e dannose per l'ambiente vengono effettuate prove con dei catalizzatori alternativi di tipo eterogenei.
Limiti
[modifica | modifica wikitesto]In tutti i casi, solo gli esteri possono utilizzarsi con componenti acilici stabili in grado di resistere alle dure condizioni del riarrangiamento di Fries. Se il componente aromatico o acilico viene fortemente sostituito, il rendimento chimico diminuisce a causa di vincoli sterici. La disattivazione di gruppi meta-direttori sul benzene produce anche un effetto avverso come può essere previsto dai calcoli per un'acilazione di Friedel-Crafts.
Il requisito per quantità equimolari del catalizzatore, le condizioni corrosive e tossiche (HF), e la reazione violenta del catalizzatore con l'acqua hanno portato allo sviluppo di nuovi protocolli. Le zeoliti si sono dimostrate inadatte, poiché sono disattivate, ma acidi forti, come gli acidi solfonici, danno un'alternativa ragionevole.
Riarrangiamento foto-Fries
[modifica | modifica wikitesto]Oltre alla normale reazione termica dell'estere fenilico esiste una reazione fotochimica detta riarrangiamento foto-Fries[7] che coinvolge un meccanismo di reazione radicale. Questa reazione è anche possibile con la disattivazione di sostituenti sul gruppo aromatico.. Because the yields are low this procedure is not used in commercial production. However, photo-Fries rearrangement may occur naturally, for example when a plastic bottle made of polycarbonate (PC) is exposed to the sun, particularly to UV light at a wavelength of about 310 nm, if the plastic has been heated to 40° Celsius or above (as might occur in a car with windows closed on a hot summer day). In this case, photolysis of the ester groups would lead to leaching of phthalate from the plastic.[8]
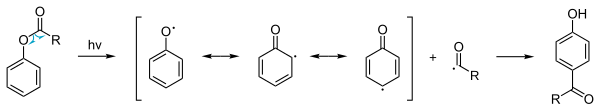
Riarrangiamento di Fries anionico
[modifica | modifica wikitesto]In addition to Lewis acid and photo-catalysed Fries rearrangements, there also exists an anionic Fries rearrangement. In this reaction, the aryl ester undergoes ortho-metalation with a strong base, which then rearranges in a nucleophilic attack mechanism.
Voci correlate
[modifica | modifica wikitesto]- Reazione del tipo alchilazione di Friedel–Crafts:
- Riarrangiamento di Hofmann-Martius
- Riarrangiamento di Fries
- Riarrangiamento di Fischer-Hepp
Note
[modifica | modifica wikitesto]- ^ Fries, K. ; Finck, G., Über Homologe des Cumaranons und ihre Abkömmlinge, in Chemische Berichte, vol. 41, n. 3, 1908, pp. 4271–4284, DOI:10.1002/cber.190804103146.
- ^ Über ein Kondensationsprodukt des Cumaranons und seine Umwandlung in Oxindirubin, in Chemische Berichte, vol. 43, n. 1, 1910, pp. 212–219, DOI:10.1002/cber.19100430131.
- ^ March, J. Advanced Organic Chemistry, 3rd Ed.; John Wiley & Sons: Chichester, 1985; S. 499ff.
- ^ Blatt, A. H. Org. React. 1942, 1.
- ^ Malcolm Sainsbury, Aromatic Chemistry (Oxford Chemistry Primers), Oxford University Press, 1992, p. 65, ISBN 0198556748.
- ^ László Kürti, Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, p. 181, ISBN 0123694833.
- ^ Bellus, D. Advances in Photochemistry; John Wiley & Sons: Chichester, 1971; Vol. 8, 109–159.
- ^ Norma Searle, "Environmental effects on polymeric materials," pp. 313–358, in Plastics and the Environment, edited by Anthony Andrade, Wiley, 2003.
Altri progetti
[modifica | modifica wikitesto]
Collegamenti esterni
[modifica | modifica wikitesto]- Riarrangiamento di Fries accessibile dal 9-3-2009 in inglese