Cloruro di solforile
| Cloruro di solforile | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Diossido dicloruro di zolfo(VI) | |
| Nomi alternativi | |
| solfonil cloruro cloruro solforico dicloruro di solforile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | SO2Cl2 |
| Massa molecolare (u) | 134,96 |
| Aspetto | liquido incolore, tendente al giallo per esposizione all'aria |
| Numero CAS | |
| Numero EINECS | 232-245-6 |
| PubChem | 24648 |
| SMILES | O=S(=O)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,67 |
| Solubilità in acqua | reazione energica |
| Temperatura di fusione | −54,1 °C (219,05 K) |
| Temperatura di ebollizione | 69,1 °C (342,25 K) |
| Tensione di vapore (Pa) a 293,15 K | 51100 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 314 - 335 - EUH014 |
| Consigli P | 280 - 301+330+331 - 304+340 - 305+351+338 - 309+310 [1] |
Il cloruro di solforile, SO2Cl2, è un ossialogenuro dello zolfo esavalente,[2] formato idealmente dall'unione del gruppo bivalente solforile >S(=O)2 con due atomi di cloro; può anche pensarsi ottenuto dall'acido solforico per sostituzione dei due ossidrili con due Cl. Di qui, in alcuni testi lo si trova indicato anche come il cloruro dell'acido solforico.[3]
A temperatura ambiente si presenta come un liquido mobile e incolore che fuma all'aria, dall'odore pungente.[4] Analogamente al cloruro di tionile, l'analogo con lo zolfo(IV), non lo si trova in natura per la sua elevata tendenza a subire un'idrolisi che porta rapidamente ad acido solforico e acido cloridrico, secondo la violenta reazione seguente:
Per questo i suoi vapori sono fortemente irritanti e lacrimogeni.[5]
Struttura
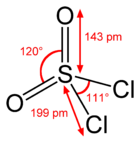
[modifica | modifica wikitesto]Nella molecola SO2Cl2 un atomo di zolfo è al centro di un tetraedro distorto; due vertici del tetraedro sono occupati da due atomi di cloro uniti a S con legame semplice; gli altri due vertici ospitano due atomi di ossigeno uniti a S con doppio legame, come di solito viene rappresentato o, secondo altri, con legame dativo S-->O; in ogni caso, la lunghezza di questo legame (143 pm) è notevolmente minore di quella tipica per un legame semplice (157,4 pm in S-OH di H2SO4[6]) ed è consistente con un ordine di legame di 2. L'atomo centrale S è sostanzialmente ibridato sp3; l'angolo O-S-O è notevolmente più ampio di quello tetraedrico, mentre quello Cl-S-Cl lo è solo di pochissimo: ciò risulta in accordo qualitativo con le previsioni della teoria VSEPR che assegna maggior spazio angolare al legame doppio rispetto al legame semplice.[7][8] Il risultato per la molecola è di un abbassamento della simmetria da Td a C2v, conferendo quindi alla molecola la simmetria del bisfenoide.[9] SO2Cl2 è una molecola polare, μ = 1,81 D,ben più del cloruro di tionile SOCl2 (1,45 D).[10] La molecola è isoelettronica di valenza con il cloruro di selenoile (SeO2Cl2) e il cloruro di cromile (CrO2Cl2), ma anche con il fluoruro di solforile (SO2F2).
Il liquido, di modesta costante dielettrica (εr = 10),[10] è solubile in etere, benzene, toluene, CHCl3, CCl4 e acido acetico glaciale.[4]
Sintesi
[modifica | modifica wikitesto]Il cloruro di solforile viene sintetizzato, in condizioni controllate di pressione e temperatura, a partire da anidride solforosa e cloro gassosi utilizzando come catalizzatore il carbone attivo:[3]
Il prodotto impuro può essere purificato per distillazione frazionata.
Si ottiene anche per ossidazione di cloruro di zolfo con ossigeno in presenza di cloro o per decomposizione termica (180 °C) di acido clorosolforico. In ogni caso il cloruro di solforile grezzo viene purificato per distillazione frazionata.
Usi
[modifica | modifica wikitesto]Il cloruro di solforile è utilizzato nella sintesi chimica in qualità di fonte di cloro, più pratico e maneggiabile rispetto all'alogeno. I suoi usi principali riguardano la formazione di α-alogenuri di composti organici attivati dalla presenza di carbonili (R2C=O) o solfossidi (R2S=O), ma anche di cloroderivati di altri composti quali gli idrocarburi e gli epossidi. SO2Cl2 è anche in grado di reagire con gli alcoli producendo cloruri alchilici.
Reazioni
[modifica | modifica wikitesto]Mettendo a contatto con l'acqua il cloruro di solforile si ha una violenta reazione chimica che produce acido solforico liquido e acido cloridrico gassoso.
Alla temperatura di 100 °C inizia a decomporsi in cloro e anidride solforosa. Con zolfo a 200 °C si formano cloruri di zolfo e anidride solforosa; con acido solfidrico reagisce dando zolfo, anidride solforosa, acido cloridrico e cloruro di zolfo; con acido solforico concentrato a 700 °C si forma acido clorosolforico mentre con ammoniaca in eccesso si ottengono cloruro di ammonio e derivati solfonammidici.
In ambito industriale viene principalmente utilizzato per la produzione di pesticidi e nell'industria tessile per evitare il restringimento della lana.
Note
[modifica | modifica wikitesto]- ^ scheda del cloruro di solforile su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Un suo analogo con un metallo esavalente al posto dello zolfo è il cloruro di cromile CrO2Cl2, isoelettronico di valenza e isostrutturale.
- ^ a b N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 694, ISBN 0-7506-3365-4.
- ^ a b (EN) PubChem, Sulfuryl chloride, su pubchem.ncbi.nlm.nih.gov. URL consultato il 4 febbraio 2022.
- ^ Sulfuryl_chloride, su chemeurope.com. URL consultato il 4 febbraio 2022.
- ^ (EN) Robert L. Kuczkowski, R. D. Suenram e Frank J. Lovas, Microwave spectrum, structure, and dipole moment of sulfuric acid, in Journal of the American Chemical Society, vol. 103, n. 10, 1981-05, pp. 2561–2566, DOI:10.1021/ja00400a013. URL consultato il 28 febbraio 2021.
- ^ J.E. Huheey, E.A. Keiter e R.L. Keiter, 6 - La struttura e la reattività delle molecole, in Chimica Inorganica, Seconda edizione italiana, sulla quarta edizione inglese, Piccin Nuova Libraria, Padova, 1999, pp. 209-223, ISBN 88-299-1470-3.
- ^ G. L. Miessler e D. A. Tarr, Inorganic Chemistry, 2nd, Prentice-Hall, 1999, pp. 54–62, ISBN 978-0-13-841891-5.
- ^ H. S. M. Coxeter, Regular Polytopes, 3rd, Dover Publications, 1973, p. 15, ISBN 0-486-61480-8.
- ^ a b sulfuryl chloride, su stenutz.eu. URL consultato il 28 febbraio 2021.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Cloruro di solforile
Wikimedia Commons contiene immagini o altri file su Cloruro di solforile
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) sulfuryl chloride / sulfonyl chloride, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.

