Omotaurina
| Omotaurina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 3-Aminopropane-1-sulfonic acid | |
| Nomi alternativi | |
| Tramiprosate; 3-APS; 3-Amino-1-propanesulfonic acid; 3-aminopropanesulphonic acid; 3-aminopropane-1-sulfonic acid | |
| Caratteristiche generali | |
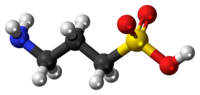
| Formula bruta o molecolare | C3H9NO3S |
| Massa molecolare (u) | 139.17 g/mol |
| Numero CAS | |
| Numero EINECS | 222-977-4 |
| PubChem | 1646 e 6991996 |
| DrugBank | DBDB06527 |
| SMILES | C(CN)CS(=O)(=O)O |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 293 °C |
| Dati farmacologici | |
| Categoria farmacoterapeutica | GABA Agonista |
| Indicazioni di sicurezza | |
L'omotaurina (acido 3-ammino-1-propansolfonico (3-APS) o tramiprosato (INN)) è un composto organico solforato sintetico. Esso è analogo alla taurina, ma ha un carbonio supplementare nella sua struttura chimica. Chimicamente possiede 3 gruppi NH capaci di creare un legame ad idrogeno ciascuno.[1]
Possiede una documentata attività antiepilettica di tipo GABA-ergica, somigliando chimicamente al GABA ed essendo un suo agonista.[2] In realtà è un agonista del GABAA ed un antagonista del GABAB.
Storia
[modifica | modifica wikitesto]Il nome è stato scelto per la somiglianza strutturale con la taurina. Identificata per la prima volta in differenti specie di alghe rosse marine: Acrosorium uncinatum, Cladophora densa, Chondrus ocellatus, Gratelupia livida e Rhodymenia palmata specie che usano l'omotaurina come unica fonte di azoto per la crescita.[3] Successivamente è stata ottenuta per via sintetica.[4]
Farmacodinamica
[modifica | modifica wikitesto]La presenza di un atomo di zolfo nella molecola suggerisce un ruolo protettivo nei confronti dello stress ossidativo a carico del DNA causato da radicali liberi prodotti dall’ossidazione delle catecolammine.[4]
Agisce prevalentemente sulle cellule del Purkinje e sulle cellule corticali cerebrali.[5] In studi preclinici si è visto che la molecola si lega alla β-amiloide inibendo la formazione di aggregati fibrillari neurotossici.[6][7][8]
L'omotaurina ha anche mostrato di possedere attività anticonvulsivanti[9] per un'azione inibente l'attività dell'acido glutammico.[10]
Inoltre, è capace di ridurre il tono muscolare scheletrico incrementando la conduttanza allo ione cloro;[11] ed infine, possiede anche attività di tipo ipotermizzanti.[5][12]
Nel ratto mostra un'interessante attività anti assunzione di alcool,[13] ed anche in altri modelli animali.[2]
Ricerche cliniche
[modifica | modifica wikitesto]Ricercatori italiani hanno visto come l'omotaurina sia in grado di garantire una neuroprotezione sulle cellule gangliari della retina nell'animale;[14] ed ancora, l'omotaurina nell'uomo, insieme ad altri composti in associazione, è in grado di migliorare la pressione intraoculare e l'elettro-retinogramma in soggetti con glaucoma ad angolo aperto.[15]
Ricercatori italiani dell'University College di Londra hanno visto in uno studio clinico su uomini affetti da malattia di Parkinson che l'omotaurina è in grado di migliorare una scala di valutazione delle disabilità e la sonnolenza diurna dei soggetti trattati con 100 mg al giorno, senza aver avuto effetti collaterali; suggerendo un ruolo nel controllo del ritmo sonno veglia dei soggetti con Parkinson.[16]
Studio ALPHASE
[modifica | modifica wikitesto]In trial clinico di fase III policentrico del 2011 coordinato dalla University of California La Jolla di San Diego, per 78 settimane 2.000 pazienti sono stati arruolati in EU e negli USA, con un dosaggio di 100–150 mg bis in die di omotaurina al fine di verificare in soggetti con malattia di Alzheimer la capacità dell'omotaurina di ridurre la perdita di memoria. Inoltre lo studio ha strumentalmente verificato che l'omotaurina è in grado di ridurre in maniera significativa la perdita del volume dell'ippocampo.[17]
Note
[modifica | modifica wikitesto]- ^ Bulletin of the Chemical Society of Japan, Chemical Society of Japan., 1973.
- ^ a b Daniel Lednicer, The Organic Chemistry of Drug Synthesis, John Wiley & Sons, 14 dicembre 2007, pp. 15–, ISBN 978-0-470-18066-2.
- ^ Mayer J, Cook AM, Homotaurine metabolized to 3-sulfopropanoate in Cupriavidus necator H16: enzymes and genes in a patchwork pathway, in J. Bacteriol., vol. 191, n. 19, 2009, pp. 6052–8, DOI:10.1128/JB.00678-09, PMC 2747907, PMID 19648235.
- ^ a b Carlo Caltagirone, et al.,, Il ruolo dell’omotaurina nella prevenzione del declino cognitivo da AD (PDF), su integratoribiomed.it, Psicogeriatria, Anno VI - Numero 2, maggio-agosto 2011.
- ^ a b N.S. Abel Lajtha, Metabolism in the Nervous System, Springer Science & Business Media, 9 marzo 2013, pp. 520–, ISBN 978-1-4684-4367-7.
- ^ Aisen PS, Gauthier S, Vellas B, Briand R, Saumier D, Laurin J, Garceau D, Alzhemed: a potential treatment for Alzheimer's disease, in Current Alzheimer Research, vol. 4, n. 4, 2007, pp. 473–8, DOI:10.2174/156720507781788882, PMID 17908052.
- ^ Caltagirone C, Ferrannini L, Marchionni N, Nappi G, Scapagnini G, Trabucchi M, The potential protective effect of tramiprosate (homotaurine) against Alzheimer's disease: a review, in Aging Clin Exp Res, vol. 24, n. 6, 2012, pp. 580–7, DOI:10.3275/8585, PMID 22961121.
- ^ Farid Rahimi and Gal Bitan, Non-fibrillar Amyloidogenic Protein Assemblies - Common Cytotoxins Underlying Degenerative Diseases, Springer Science & Business Media, 13 gennaio 2012, pp. 480–, ISBN 978-94-007-2773-1.
- ^ E. S. Vizi, J. Knoll e Magyar Farmacológiai Társaság, Advances in pharmacological research and practice: proceedings of the 3th Congress of the Hungarian Pharmacological Society, Budapest, 1979, Pergamon Press, 1980, ISBN 978-963-05-2476-6.
- ^ Fariello RG, Golden GT, Pisa M, Homotaurine (3 aminopropanesulfonic acid; 3APS) protects from the convulsant and cytotoxic effect of systemically administered kainic acid, in Neurology, vol. 32, n. 3, 1982, pp. 241–5, PMID 7199633.
- ^ Pierno S, Tricarico D, De Luca A, Campagna F, Carotti A, Casini G, Conte Camerino DC, Effects of taurine analogues on chloride channel conductance of rat skeletal muscle fibers: a structure-activity relationship investigation, in Naunyn Schmiedebergs Arch. Pharmacol., vol. 349, n. 4, 1994, pp. 416–21, PMID 8058113.
- ^ DeFeudis FV, Involvement of GABA and other inhibitory amino acids in thermoregulation, in Gen. Pharmacol., vol. 15, n. 6, 1984, pp. 445–7, PMID 6396158.
- ^ Claudio A. Naranjo and Edward M. Sellers, Novel Pharmacological Interventions for Alcoholism, Springer Science & Business Media, 6 dicembre 2012, pp. 338–, ISBN 978-1-4612-2878-3.
- ^ Russo R, Adornetto A, Cavaliere F, Varano GP, Rusciano D, Morrone LA, Corasaniti MT, Bagetta G, Nucci C, Intravitreal injection of forskolin, homotaurine, and L-carnosine affords neuroprotection to retinal ganglion cells following retinal ischemic injury, in Mol. Vis., vol. 21, 2015, pp. 718–29, PMC 4483367, PMID 26167113.
- ^ Mutolo MG, Albanese G, Rusciano D, Pescosolido N, Oral Administration of Forskolin, Homotaurine, Carnosine, and Folic Acid in Patients with Primary Open Angle Glaucoma: Changes in Intraocular Pressure, Pattern Electroretinogram Amplitude, and Foveal Sensitivity, in J Ocul Pharmacol Ther, vol. 32, n. 3, 2016, pp. 178–183, DOI:10.1089/jop.2015.0121, PMID 26771282.
- ^ Ricciardi L, De Nigris F, Specchia A, Fasano A, Homotaurine in Parkinson's disease, in Neurol. Sci., vol. 36, n. 9, 2015, pp. 1581–7, DOI:10.1007/s10072-015-2201-6, PMID 25894843.
- ^ Aisen PS, Gauthier S, Ferris SH, Saumier D, Haine D, Garceau D, Duong A, Suhy J, Oh J, Lau WC, Sampalis J, Tramiprosate in mild-to-moderate Alzheimer's disease - a randomized, double-blind, placebo-controlled, multi-centre study (the Alphase Study), in Arch Med Sci, vol. 7, n. 1, 2011, pp. 102–11, DOI:10.5114/aoms.2011.20612, PMC 3258678, PMID 22291741.
Bibliografia
[modifica | modifica wikitesto]- Wright TM, Tramiprosate, in Drugs Today, vol. 42, n. 5, 2006, pp. 291–8, DOI:10.1358/dot.2006.42.5.973584, PMID 16801992.
- Caltagirone C, Ferrannini L, Marchionni N, Nappi G, Scapagnini G, Trabucchi M, The potential protective effect of tramiprosate (homotaurine) against Alzheimer's disease: a review, in Aging Clin Exp Res, vol. 24, n. 6, 2012, pp. 580–7, DOI:10.3275/8585, PMID 22961121.
- James J. Kocsis, S.I. Baskin and Stephen W. Schaffer, The Effects of Taurine on Excitable Tissues: Proceedings of the 21st Annual A. N. Richards Symposium of the Physiological Society of Philadelphia, Valley Forge, Pennsylvania, April 23–24, 1979, Springer Science & Business Media, 6 dicembre 2012, pp. 406–, ISBN 978-94-009-8093-8.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Omotaurina
Wikimedia Commons contiene immagini o altri file su Omotaurina
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Homotaurine | C3H9NO3S, su pubchem.ncbi.nlm.nih.gov, PubChem.
- (EN) Homotaurine: Uses, Side Effects, Interactions and Warnings, su webmd.com, WebMD.
- (EN) 3-Amino-1-propanesulfonic acid 97% |, su sigmaaldrich.com, Sigma-Aldrich.