Mielinolisi pontina centrale
| Mielinolisi pontina centrale | |
|---|---|
 | |
| Specialità | neurologia |
| Classificazione e risorse esterne (EN) | |
| MeSH | D017590 |
| MedlinePlus | 000775 |
| eMedicine | 1174329 |
| Sinonimi | |
| Sindrome da demielinizzazione osmotica | |

La mielinolisi pontina centrale (CPM), conosciuta anche come sindrome da demielinizzazione osmotica, è una malattia neurologica causata da un grave danno a carico della guaina di mielina delle cellule nervose che costituiscono il ponte del tronco encefalico. La causa della malattia è prevalentemente iatrogena. Si caratterizza per l'insorgenza di paralisi acuta, disfagia (difficoltà a deglutire), disartria (difficoltà a parlare), e altri sintomi neurologici.
Può verificarsi anche in altre zone cerebrali esterne al ponte,[1] per questo alcuni autori ritengono più corretto il termine sindrome da demielinizzazione osmotica che permette di comprendere anche un coinvolgimento di aree esterne al ponte.[2]
La mielinolisi pontina centrale si presenta più comunemente come complicanza del trattamento dei soggetti affetti da grave iponatriemia, spesso a seguito di concentrazioni di natriemia che mettono a rischio la vita del paziente. La sindrome si verifica come conseguenza di un rapido aumento della tonicità sierica dopo trattamento di individui con iponatremia grave e cronica, che presentano adattamenti intracellulari allo stato di ipotonia persistente in cui versano. Al fine di prevenire la mielinolisi pontina centrale, l'iponatriemia deve essere corretta ad una velocità non superiore a 12-20 mmol/L di sodio al giorno.[3] Anche se è meno comune, la sindrome può anche presentarsi in soggetti con una storia di alcolismo cronico o di altre condizioni legate ad una ridotta funzionalità epatica. In questi casi, la condizione è spesso correlata alla correzione delle concentrazioni di sodio o dello squilibrio elettrolitico.
Storia
[modifica | modifica wikitesto]La prima descrizione della mielinolisi pontina centrale (CPM), come entità clinica unica, si deve ad Adams e collaboratori. Gli studi su quest'entità furono pubblicati nel 1958 grazie alle osservazioni eseguite su pazienti che soffrivano di problemi e patologie correlate all'alcool oppure alla malnutrizione.[4] Questi pazienti sviluppavano tetraparesi spastica, paralisi pseudobulbare, e vari gradi di encefalopatia o coma, causati da demielinizzazione acuta, non su base infiammatoria, localizzata a livello del ponte di Varolio.
Successivamente divenne chiaro come il disturbo fosse prevalentemente associato all'iponatriemia grave e prolungata, in particolare quando questa viene trattata in modo eccessivamente energico e con troppa rapidità.[5] Per questo motivo, in anni recenti, gli studiosi raccomandano di individuare per tempo i pazienti che presentano condizioni predisponenti alla sindrome e quindi eseguire un trattamento delle alterazioni elettrolitiche più graduale e ponderato, proprio al fine di ridurre l'incidenza di questa grave forma di mielinolisi osmotica.[6]
Epidemiologia
[modifica | modifica wikitesto]Il disturbo è certamente raro e si sviluppa occasionalmente perfino in soggetti con iponatremia cronica e trattati in modo aggressivo. La sua esatta incidenza è sconosciuta e non esistono, allo stato, indagini epidemiologiche al riguardo. In uno studio effettuato post-mortem su pazienti sottoposti a trapianto di fegato è stato dimostrato che la mielinolisi pontina centrale era presente in circa il 30% dei soggetti. Il disturbo sembra presentarsi più frequentemente nelle femmine che nei maschi.
Eziologia
[modifica | modifica wikitesto]
La causa più comune è una correzione troppo rapida delle concentrazioni di sodio in caso di iponatriemia.
Statisticamente nei pazienti iponatriemici alcune condizioni facilitano l'insorgenza di mielinolisi pontina centrale, in particolare una natriemia <120 mEq/L che si mantiene per più di 48 ore, un trattamento che si avvale di una aggressiva terapia con fluidi endovena ed il ricorso a soluzioni saline ipertoniche, infine lo sviluppo di ipernatriemia durante il trattamento.
Tuttavia si deve notare che la mielinolisi pontina centrale si verifica raramente perfino in soggetti che hanno sviluppato iponatremia cronica e sono stati trattati in modo aggressivo e troppo rapido per risolvere il disturbo elettrolitico.
La gran parte di questi pazienti non sviluppa mielinolisi pontina centrale. Evidentemente debbono esistere altri fattori di rischio e/o condizioni predisponenti che tuttora sfuggono alla comprensione degli studiosi.
La sindrome colpisce anche soggetti alcolisti cronici che manifestano una classica sintomatologia astinenziale.[7] In questi casi la sindrome sembra completamente non correlata all'iponatriemia o ad una sua correzione troppo rapida. In letteratura viene anche riportato che la sindrome può complicare anche altre condizioni:
- Intervento chirurgico di trapianto di fegato[8][9][10][11]
- Intervento chirurgico per trapianto di cellule staminali[12]
- Gravi ustioni[13][14]
- Malnutrizione
- Anoressia[15][16][17]
- Gravi disturbi elettrolitici
- AIDS
- Sindrome di Wernicke-Korsakoff[18][19]
- Iponatremia da dialisi peritoneale
- Iperemesi gravidica[20][21]
Fisiopatologia
[modifica | modifica wikitesto]Attualmente si ritiene che le cellule del cervello siano in grado di regolare la loro osmolarità modificando le concentrazioni di alcune sostanze ad attività osmotica come ad esempio inositolo, betaina e glutammina. In caso di iponatriemia le concentrazioni di queste sostanze cadono, conseguentemente le cellule si rigonfiano di acqua. Un meccanismo simile, ma opposto, si verifica in caso di ipernatremia: in quest'ultimo caso le cellule si "restringono" perdendo liquidi nel tentativo di andare a diluire il liquido esterno alla cellula, ipernatriemico. Si comprende perciò come una rapida correzione della natriemia potrebbe causare una relativa ipertonia del liquido extracellulare. In conseguenza di ciò "acqua libera" esce dalle cellule per andare a diminuire questo ipertono relativo. Sembra che sia questo il meccanismo che porta alla mielinolisi pontina centrale, la quale clinicamente viene a manifestarsi come paralisi. Il cervello sembra ridursi nelle sue dimensioni. La demielinizzazione degli assoni (le fibre nervose del cervello) li viene a danneggiare gravemente. Nel contesto di una natriemia cronicamente bassa, le cellule del cervello (neuroni e cellule gliali) si adeguano: l'effetto netto è quello di spostare acqua fuori dall'interstizio ed equilibrare (o quasi) la tonicità intracellulare e quella extracellulare. L'iponatremia cronica viene perciò ad essere compensata.
Con la correzione dell'iponatriemia attraverso la somministrazione di fluidi endovenosi, la tonicità intra ed extracellulare varia nuovamente, questa volta in direzione opposta. Con l'uso di soluzione salina ipertonica per via endovenosa, la correzione può essere troppo veloce, e ciò non consente tempo sufficiente alle cellule del cervello di adeguarsi alle nuove condizioni di tonicità.
In circa il 10% dei pazienti con mielinolisi pontina centrale, la demielinizzazione riguarda aree cerebrali diverse da quella pontina, ad esempio il talamo, i nuclei della base e il cervelletto.
Il meccanismo preciso che porta alla distruzione della guaina mielinica non è ancora conosciuto. Tuttavia l'ipotesi che, in diverse regioni cerebrali caratterizzate dalla presenza ravvicinata di aree di materia bianca e grigia, sia proprio l'edema cellulare (causato da variazioni di tipo osmotico, a determinare la compressione dei tratti di fibre nervose, inducendo la demielinizzazione, risulta quella più accreditata.[22][23][24] Verosimilmente proprio nel ponte, ove avviene l'incrociamento a griglia fra fibre longitudinali di passaggio e fibre trasversali che si portano in direzione del cervelletto, l'edema cellulare osmotico è in grado di provocare una sorta di “strangolamento assonale” che evolve in demielinizzazione.
Segni e sintomi
[modifica | modifica wikitesto]La sindrome può presentarsi in modo molto eterogeneo, a seconda dell'area del cervello che viene ad essere danneggiata. Generalmente compaiono confusione mentale, delirio, convulsioni, letargia e alterazioni dello stato di coscienza, cambiamento della postura e dell'andatura, nonché la diminuzione o la cessazione della funzione respiratoria.[25][26]
I sintomi che si osservano con maggiore frequenza in questo disturbo sono la paraparesi oppure la tetraplegia acuta, la disfagia, disartria (difficoltà di linguaggio), diplopia, e la perdita di coscienza. Possono inoltre associarsi allucinazioni, tremore alle mani, spasmi a carico di diversi gruppi muscolari facciali o degli arti, anisocoria e altri sintomi neurologici correlati a danni del tronco encefalico.
È stata inoltre segnalata la possibilità che si verifichi una sindrome locked-in, ovvero una situazione di tetraplegia e paralisi della maggior parte dei muscoli a controllo bulbare, nella quale, tuttavia, il paziente non perde le funzioni cerebrali superiori e di tipo cognitivo. Questa sindrome sembra essere la conseguenza di una rapida mielinolisi delle vie corticobulbari e corticospinali nel tronco encefalico.
Diagnosi
[modifica | modifica wikitesto]
L'esame neurologico può mettere in evidenza alterazione dei riflessi osteotendinei, paralisi dei nervi cranici, deficit di forza di tutti e quattro gli arti (tetraparesi spastica), alterazioni dei movimenti oculari, segni suggestivi di malattia del motoneurone (debolezza di una mano, di una gamba, debolezza dei muscoli mimici facciali o di quelli che permettono di parlare o di deglutire).
Esami di laboratorio
[modifica | modifica wikitesto]L'esame del liquor cefalorachidiano (CSF) è raramente utile, tranne che per motivi di diagnosi differenziale. Gli studi del liquor possono comunque mettere in evidenza un aumento delle proteine e del numero di leucociti (pleocitosi).
Esami strumentali
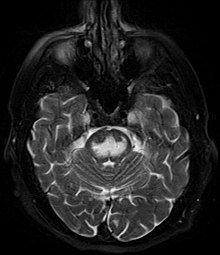
[modifica | modifica wikitesto]Una risonanza magnetica (RM) dell'encefalo è l'esame strumentale principale. In alternativa, pur con una minore capacità di risoluzione, è possibile eseguire una tomografia assiale computerizzata. Un gran numero di pazienti presentano una TC o RM iniziale normale e in molti casi le lesioni non divengono evidenti prima che siano passate diverse settimane dall'insorgenza acuta dei sintomi.[27]
Tipicamente nella RM le immagini T2-pesate dimostrano la presenza di zone iperintense o luminose a dimostrazione della avvenuta demielinizzazione di quelle aree, ed in conseguenza di un relativo aumento del contenuto di acqua in quelle regioni.[28][29]
L'elettroencefalografia è molto poco specifica e si limita a evidenziare un diffuso rallentamento dell'attività cerebrale.
I potenziali evocati del tronco cerebrale possono anticipare temporalmente le anomalie evidenziabili grazie alle tecniche di neuroimaging.
Trattamento
[modifica | modifica wikitesto]Il trattamento del paziente è di supporto. Poiché la mielinolisi è quasi sempre una conseguenza di una correzione troppo rapida di uno stato di iponatriemia cronica, si ritiene che la correzione non dovrebbe eccedere la velocità di 10 mmol/L/giorno o 0,5 mEq/L/ora.[3] Anche se esistono ancora alcune controversie sul tasso di correzione, vi è accordo generale sul fatto che deve essere evitata l'ipernatriemia.
I pazienti affetti da alcolismo devono ricevere un'adeguata integrazione di vitamine (particolarmente di tiamina o vitamina B1) ed attentamente valutati nel loro stato nutrizionale. Ciò aiuta a prevenire quei casi di demielinizzazione che si associano ad encefalopatia di Wernicke.
Sfortunatamente una volta instauratosi il processo di demielinizzazione non esiste una cura o un trattamento specifico. Le uniche cure possibili sono di supporto, con l'obiettivo di prevenire alcune possibili complicazioni come la polmonite ab ingestis, la trombosi venosa profonda, le piaghe da decubito.
Una volta che il paziente si sia clinicamente stabilizzato, è opportuno che sia valutato da uno specialista in neuroriabilitazione ed eventualmente trasferito per eseguire adeguate terapia orientate al recupero delle capacità funzionali residue.
Prognosi
[modifica | modifica wikitesto]La prognosi di questi pazienti è scarsa e l'evoluzione verso la morte un evento comune, spesso entro pochi giorni dalla rapida evoluzione verso il coma. Tuttavia dati recenti indicano che la prognosi anche dei pazienti critici possa essere migliore di quanto si ritenga normalmente, nonostante le gravi manifestazioni cliniche iniziali[30] e una certa tendenza da parte dei rianimatori a sottostimare una possibile evoluzione favorevole.[31] La maggior parte dei pazienti comunque sopravvive, ma solo circa un terzo recupera completamente. I restanti sopravvissuti presentano disabilità di vario grado, spesso estremamente gravi. Dei sopravvissuti circa un terzo, pur disabile, è ancora in grado di vivere autonomamente.[32] Le disabilità permanenti variano da tremori minori fino all'atassia e a segni di gravi danni cerebrali, come ad esempio la tetraparesi spastica e la sindrome locked-in. Una volta che la condizione si è stabilizzata, si possono osservare alcuni lenti miglioramenti, che talvolta richiedono diversi mesi.
Le possibili complicazioni possono essere:
- Polmonite da aspirazione
- Necessità di respirazione assistita (ventilazione artificiale)
- Trombosi venose profonde
- Embolia polmonare
- Contratture muscolari
- Perdita della capacità di lavoro o dell'autosufficienza
- Incapacità di muoversi e conseguente perdita di massa muscolare
- Ulcere da decubito
- Infezioni ricorrenti (respiratorie e delle vie urinarie)
- Depressione
La durata del ricovero del paziente è sostanzialmente in funzione della gravità del danno assonale.[33]
Note
[modifica | modifica wikitesto]- ^ Gocht A, Colmant HJ, Central pontine and extrapontine myelinolysis: a report of 58 cases, in Clin. Neuropathol., vol. 6, n. 6, 1987, pp. 262–70, PMID 3322623.
- ^ Lampl C, Yazdi K, Central pontine myelinolysis, in Eur. Neurol., vol. 47, n. 1, 2002, pp. 3–10, PMID 11803185.
- ^ a b Babar SM, SIADH associated with ciprofloxacin, in Ann Pharmacother, vol. 47, n. 10, ottobre 2013, pp. 1359–63, DOI:10.1177/1060028013502457, PMID 24259701. URL consultato il 28 maggio 2014.
- ^ Adams RD, Victor M, Mancall EL, Central pontine myelinolysis: a hitherto undescribed disease occurring in alcoholic and malnourished patients, in AMA Arch Neurol Psychiatry, vol. 81, n. 2, febbraio 1959, pp. 154–72, PMID 13616772.
- ^ Norenberg MD, Leslie KO, Robertson AS, Association between rise in serum sodium and central pontine myelinolysis, in Ann. Neurol., vol. 11, n. 2, febbraio 1982, pp. 128–35, DOI:10.1002/ana.410110204, PMID 7073246. URL consultato il 28 maggio 2014.
- ^ Kumar S, Fowler M, Gonzalez-Toledo E, Jaffe SL, Central pontine myelinolysis, an update, in Neurol. Res., vol. 28, n. 3, aprile 2006, pp. 360–6, DOI:10.1179/016164106X110346, PMID 16687066. URL consultato il 28 maggio 2014.
- ^ Yoon B, Shim YS, Chung SW, Central pontine and extrapontine myelinolysis after alcohol withdrawal, in Alcohol Alcohol., vol. 43, n. 6, 2008, pp. 647–9, DOI:10.1093/alcalc/agn050, PMID 18678596. URL consultato il 29 maggio 2014.
- ^ Singh N, Yu VL, Gayowski T, Central nervous system lesions in adult liver transplant recipients: clinical review with implications for management, in Medicine (Baltimore), vol. 73, n. 2, marzo 1994, pp. 110–8, PMID 8152365.
- ^ Martinez AJ, Estol C, Faris AA, Neurologic complications of liver transplantation, in Neurol Clin, vol. 6, n. 2, maggio 1988, pp. 327–48, PMID 3047544. URL consultato il 29 maggio 2014.
- ^ Kato T, Hattori H, Nagato M, Kiuchi T, Uemoto S, Nakahata T, Tanaka K, Subclinical central pontine myelinolysis following liver transplantation, in Brain Dev., vol. 24, n. 3, aprile 2002, pp. 179–82, DOI:10.1016/S0387-7604(02)00013-X, PMID 11934516. URL consultato il 29 maggio 2014.
- ^ Zivković SA, Neurologic complications after liver transplantation, in World J Hepatol, vol. 5, n. 8, agosto 2013, pp. 409–16, DOI:10.4254/wjh.v5.i8.409, PMC 3767839, PMID 24023979. URL consultato il 29 maggio 2014.
- ^ Lim KH, Kim S, Lee YS, Kim KH, Kim J, Rhee Jy, Kim HJ, Yi HG, Oh SY, Lim JH, Han SW, Lee S, Kim I, Yoon SS, Park S, Kim BK, Central pontine myelinolysis in a patient with acute lymphoblastic leukemia after hematopoietic stem cell transplantation: a case report, in J. Korean Med. Sci., vol. 23, n. 2, aprile 2008, pp. 324–7, DOI:10.3346/jkms.2008.23.2.324, PMC 2526450, PMID 18437020. URL consultato il 29 maggio 2014.
- ^ McKee AC, Winkelman MD, Banker BQ, Central pontine myelinolysis in severely burned patients: relationship to serum hyperosmolality, in Neurology, vol. 38, n. 8, agosto 1988, pp. 1211–7, PMID 3399069.
- ^ Winkelman MD, Galloway PG, Central nervous system complications of thermal burns. A postmortem study of 139 patients, in Medicine (Baltimore), vol. 71, n. 5, settembre 1992, pp. 271–83, PMID 1522803.
- ^ Sugimoto T, Murata T, Omori M, Wada Y, Central pontine myelinolysis associated with hypokalaemia in anorexia nervosa, in J. Neurol. Neurosurg. Psychiatr., vol. 74, n. 3, marzo 2003, pp. 353–5, PMC 1738317, PMID 12588925. URL consultato il 29 maggio 2014.
- ^ Keswani SC, Central pontine myelinolysis associated with hypokalaemia in anorexia nervosa, in J. Neurol. Neurosurg. Psychiatr., vol. 75, n. 4, aprile 2004, pp. 663; author reply 663, PMC 1739009, PMID 15026526. URL consultato il 29 maggio 2014.
- ^ Leroy S, Gout A, Husson B, de Tournemire R, Tardieu M, Centropontine myelinolysis related to refeeding syndrome in an adolescent suffering from anorexia nervosa, in Neuropediatrics, vol. 43, n. 3, giugno 2012, pp. 152–4, DOI:10.1055/s-0032-1307458, PMID 22473289. URL consultato il 29 maggio 2014.
- ^ Kantor S, Prakash S, Chandwani J, Gokhale A, Sarma K, Albahrani MJ, Wernicke's encephalopathy following hyperemesis gravidarum, in Indian J Crit Care Med, vol. 18, n. 3, marzo 2014, pp. 164–6, DOI:10.4103/0972-5229.128706, PMC 3963199, PMID 24701066. URL consultato il 29 maggio 2014 (archiviato dall'url originale il 29 maggio 2014).
- ^ Kishimoto Y, Ikeda K, Murata K, Kawabe K, Hirayama T, Iwasaki Y, Rapid development of central pontine myelinolysis after recovery from Wernicke encephalopathy: a non-alcoholic case without hyponatremia, in Intern. Med., vol. 51, n. 12, 2012, pp. 1599–603, PMID 22728498. URL consultato il 29 maggio 2014.
- ^ Bergin PS, Harvey P, Wernicke's encephalopathy and central pontine myelinolysis associated with hyperemesis gravidarum, in BMJ, vol. 305, n. 6852, agosto 1992, pp. 517–8, PMC 1882865, PMID 1393001.
- ^ Sutamnartpong P, Muengtaweepongsa S, Kulkantrakorn K, Wernicke's encephalopathy and central pontine myelinolysis in hyperemesis gravidarum, in J Neurosci Rural Pract, vol. 4, n. 1, gennaio 2013, pp. 39–41, DOI:10.4103/0976-3147.105608, PMC 3579041, PMID 23546346. URL consultato il 29 maggio 2014 (archiviato dall'url originale il 29 maggio 2014).
- ^ Haspolat S, Duman O, Senol U, Yegin O, Extrapontine myelinolysis in infancy: report of a case, in J. Child Neurol., vol. 19, n. 11, novembre 2004, pp. 913–5, PMID 15658799.
- ^ Tănăsescu R, Ticmeanu M, Cojocaru IM, Luca D, Nicolau A, Hristea A, Băicuş C, Central pontine and extrapontine myelinolysis, in Rom J Intern Med, vol. 46, n. 3, 2008, pp. 199–205, PMID 19366078.
- ^ Karp BI, Laureno R, Pontine and extrapontine myelinolysis: a neurologic disorder following rapid correction of hyponatremia, in Medicine (Baltimore), vol. 72, n. 6, novembre 1993, pp. 359–73, PMID 8231786.
- ^ Musana AK, Yale SH, Central pontine myelinolysis: case series and review, in WMJ, vol. 104, n. 6, agosto 2005, pp. 56–60, PMID 16218318.
- ^ Odier C, Nguyen DK, Panisset M, Central pontine and extrapontine myelinolysis: from epileptic and other manifestations to cognitive prognosis, in J. Neurol., vol. 257, n. 7, luglio 2010, pp. 1176–80, DOI:10.1007/s00415-010-5486-7, PMID 20148334. URL consultato il 29 maggio 2014.
- ^ Graff-Radford J, Fugate JE, Kaufmann TJ, Mandrekar JN, Rabinstein AA, Clinical and radiologic correlations of central pontine myelinolysis syndrome, in Mayo Clin. Proc., vol. 86, n. 11, novembre 2011, pp. 1063–7, DOI:10.4065/mcp.2011.0239, PMC 3202996, PMID 21997578. URL consultato il 29 maggio 2014.
- ^ DeWitt LD, Buonanno FS, Kistler JP, Zeffiro T, DeLaPaz RL, Brady TJ, Rosen BR, Pykett IL, Central pontine myelinolysis: demonstration by nuclear magnetic resonance, in Neurology, vol. 34, n. 5, maggio 1984, pp. 570–6, PMID 6538649.
- ^ Fleming JD, Babu S, Images in clinical medicine. Central pontine myelinolysis, in N. Engl. J. Med., vol. 359, n. 23, dicembre 2008, pp. e29, DOI:10.1056/NEJMicm066005, PMID 19052121. URL consultato il 29 maggio 2014.
- ^ Louis G, Megarbane B, Lavoué S, Lassalle V, Argaud L, Poussel JF, Georges H, Bollaert PE, Long-term outcome of patients hospitalized in intensive care units with central or extrapontine myelinolysis*, in Critical Care Medicine, vol. 40, n. 3, marzo 2012, pp. 970–2, DOI:10.1097/CCM.0b013e318236f152, PMID 22036854. URL consultato il 30 maggio 2014.
- ^ Young GB, Central pontine myelinolysis: a lesson in humility*, in Critical Care Medicine, vol. 40, n. 3, marzo 2012, pp. 1026–7, DOI:10.1097/CCM.0b013e31823b8e0b, PMID 22343870. URL consultato il 30 maggio 2014.
- ^ Abbott R, Silber E, Felber J, Ekpo E, Osmotic demyelination syndrome, in BMJ (Clinical Research Ed.), vol. 331, n. 7520, ottobre 2005, pp. 829–30, DOI:10.1136/bmj.331.7520.829, PMC 1246086, PMID 16210283. URL consultato il 30 maggio 2014.
- ^ Medana IM, Esiri MM, Axonal damage: a key predictor of outcome in human CNS diseases, in Brain : a Journal of Neurology, vol. 126, Pt 3, marzo 2003, pp. 515–30, PMID 12566274. URL consultato il 30 maggio 2014.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su mielinolisi pontina centrale
Wikimedia Commons contiene immagini o altri file su mielinolisi pontina centrale
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) central pontine myelinolysis, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.