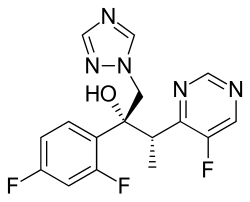
Voriconazolo
| Voriconazolo | |
|---|---|
| Nome IUPAC | |
| (2R,3S)-2-(2,4-Difluorofenil)-3-(5-fluoropirimidin-4-yl)-1-(1H-1,2,4-triazol-1-yl)butan-2-ol | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C16H14F3N5O |
| Massa molecolare (u) | 349,317 |
| Numero CAS | |
| Numero EINECS | 629-701-5 |
| Codice ATC | J02 |
| PubChem | 71616 |
| DrugBank | DB00582 |
| SMILES | CC(C1=NC=NC=C1F)C(CN2C=NC=N2)(C3=C(C=C(C=C3)F)F)O |
| Dati farmacologici | |
| Modalità di somministrazione | Orale, endovenosa |
| Dati farmacocinetici | |
| Biodisponibilità | 96% (orale) |
| Metabolismo | epatico (aldeide reduttasi) |
| Emivita | 7 ore |
| Escrezione | Urine |
| Indicazioni di sicurezza | |
Il voriconazolo, commercializzato dalla Pfizer con il nome commerciale Vfend, è un farmaco antifungino triazolico utilizzato per il trattamento delle infezioni fungine gravi.[1] È impiegato per il trattamento delle infezioni fungine invasive che di solito si riscontrano nei pazienti immunocompromessi e queste includono: candidiasi invasiva, aspergillosi invasiva e infezioni fungine emergenti. L'aumentata affinità del voriconazolo per la 14-alfa steroide demetilasi lo rende utile contro alcuni organismi resistenti al fluconazolo.[2]
Il voriconazolo è stato approvato dalla Food and Drug Administration il 24 maggio 2002.[3]
In Italia si tratta di un farmaco di classe A con ricetta di tipo RNRL e vendibile al pubblico su prescrizione da parte di centri ospedalieri o specialistici.[4]
Farmacologia[modifica | modifica wikitesto]
Indicazione d'uso[modifica | modifica wikitesto]
Per il trattamento della candidiasi esofagea, della candidemia, dell'aspergillosi polmonare invasiva, delle infezioni fungine gravi causate da Scedosporium apiospermum e Fusarium spp., VFEND è un agente antimicotico triazolico ad ampio spettro. È indicato negli adulti e nei bambini di età pari o superiore ai 2 anni.[3][1][4]
In particolare, VFEND viene impiegato nel trattamento delle seguenti condizioni associate: aspergillosi del sistema nervoso centrale e del fegato, coccidioidomicosi, endocardite causata da Aspergillus, candidiasi esofagea e orale refrattaria, infezioni fungine, meningite fungina causata da infezione da Exserohilum, infezione da Penicillium marneffei, peritonite causata da Aspergillus, infezione da Scedosporium, sinusite da Aspergillus e endoftalmite da Aspergillus.[5][4]
Inoltre, VFEND è utilizzato per il trattamento di infezioni gravi e invasive da Candida resistenti al fluconazolo, inclusa la C. krusei. Deve essere somministrato principalmente a pazienti con infezioni a carattere progressivo che possono mettere in pericolo la vita del paziente stesso. VFEND è anche indicato per la profilassi di infezioni fungine invasive in pazienti ad alto rischio sottoposti a trapianto allogenico di cellule staminali ematopoietiche (HSCT, Hematopoietic Stem Cell Transplant).[4]
Meccanismo di azione[modifica | modifica wikitesto]
Voriconazolo è impiegato per il trattamento delle infezioni fungine causate da diversi microrganismi, inclusi Aspergillus spp. e Candida spp. È un antifungino triazolico che esplica un'attività fungistatica contro i patogeni fungini. Come gli altri triazoli, voriconazolo si lega alla 14-alfa sterolo demetilasi, nota anche come CYP51, e inibisce la demetilazione del lanosterolo nel percorso di sintesi dell'ergosterolo nei lieviti e altri funghi. La mancanza di ergosterolo sufficiente compromette la funzione della membrana cellulare fungina e limita la crescita del fungo. Con la crescita fungina limitata, il sistema immunitario dell'ospite è in grado di eliminare efficacemente l'organismo invasore.[6][7][3]
Assorbimento[modifica | modifica wikitesto]
La biodisponibilità orale è stimata essere del 96% negli adulti sani. Studi farmacocinetici condotti sulla popolazione riportano una ridotta biodisponibilità nei pazienti pediatrici, con una media del 61,8% (range 44,6-64,5%), probabilmente dovuta a differenze nel metabolismo di primo passaggio o a differenze nella dieta.[8] È importante notare che anche i pazienti trapiantati presentano una biodisponibilità ridotta, ma questa aumenta nel tempo dopo il trapianto e potrebbe essere dovuta in parte a disturbi gastrointestinali derivanti dall'intervento chirurgico e da alcuni farmaci per il trapianto. Il Tmax (tempo per raggiungere la concentrazione plasmatica massima) è di 1-2 ore dopo somministrazione orale. Quando somministrato con un pasto ricco di grassi, la Cmax (concentrazione plasmatica massima) diminuisce del 34% e l'AUC (area sotto la curva) del 24%. Il pH non ha effetto sull'assorbimento del farmaco. Sono state osservate differenze nella Cmax e nell'AUC tra uomini e donne adulti sani, con un aumento del 83% nella Cmax e del 113% nell'AUC, anche se ciò non sembra avere un impatto significativo sul profilo di sicurezza del farmaco.[5]
Volume di distribuzione[modifica | modifica wikitesto]
Il volume di distribuzione stimato del voriconazolo è di 4,6 L/kg.[3] Studi farmacocinetici condotti sulla popolazione stimano il volume di distribuzione mediano di 77,6 L, con il compartimento centrale stimato a 1,07 L/kg.[8] Il voriconazolo è noto per raggiungere concentrazioni terapeutiche in molti tessuti, tra cui il cervello, i polmoni, il fegato, la milza, i reni e il cuore.[5]
Legame proteico[modifica | modifica wikitesto]
Il farmaco è legato al 58% alle proteine plasmatiche.[3]
Metabolismo[modifica | modifica wikitesto]
Il voriconazolo subisce un ampio metabolismo epatico attraverso gli enzimi del citocromo CYP2C9, CYP2C19 e CYP3A4. Il CYP2C19 mediatizza l'N-ossidazione con un Km apparente di 14 μM e una Vmax apparente di 0,22 nmol/min/nmol CYP2C19. L'N-ossido di voriconazolo è il principale metabolita circolante, rappresentando il 72% dei metaboliti radiomarcati trovati. Il CYP3A4 contribuisce all'N-ossidazione con un Km di 16 μM e una Vmax di 0,05 nmol/min/nmol CYP3A4, oltre alla 4-idrossilazione con un Km di 11 μM e una Vmax di 0,10 nmol/min/nmol CYP3A4. Il CYP3A5 e il CYP3A7 contribuiscono in misura minore all'N-ossidazione e alla 4-idrossilazione. Gli N-ossidi e i metaboliti 4-idrossilati vengono glucuronati ed eliminati attraverso l'urina insieme ad altri minori metaboliti glucuronati.
Via di eliminazione[modifica | modifica wikitesto]
Viene eliminato tramite il metabolismo epatico, con meno del 2% della dose escreta inalterata nelle urine.[3]
Emivita[modifica | modifica wikitesto]
Il farmaco segue una cinetica non lineare ed ha un'emivita terminale di eliminazione dose-dipendente.[3]
Clearance[modifica | modifica wikitesto]
La clearance è stimata essere in media di 5,25-7 L/h negli adulti sani per la porzione lineare della cinetica del farmaco.[9][8]
Tossicità[modifica | modifica wikitesto]
Negli studi clinici sono stati riportati casi di sovradosaggio accidentale del voriconazolo. Questi casi si sono verificati in pazienti pediatrici che hanno ricevuto il farmaco per via endovenosa a una dose cinque volte superiore alla massima dose raccomandata. La sola reazione avversa riportata è stata un singolo caso di fotofobia della durata di 10 minuti.[1][4][3]
Non esiste un antidoto specifico per il voriconazolo. Tuttavia, in caso di sovradosaggio, la dialisi può essere utile per eliminare il farmaco dall'organismo. Il voriconazolo viene eliminato attraverso la dialisi con una clearance di 121 ml/min.[1][3][4]
I sintomi di sovradosaggio del voriconazolo includono fotofobia e possibile prolungamento del tratto QT. In caso di sovradosaggio, è necessario un trattamento di supporto e un monitoraggio continuo dell'elettrocardiogramma. Il trattamento immediato con carbone attivo può favorire l'eliminazione del farmaco non ancora assorbito.[1][3][4]
Studi sulla cancerogenicità condotti su animali hanno evidenziato la comparsa di adenomi epatocellulari in ratti femmine a dosi di 50 mg/kg e carcinomi epatocellulari in ratti maschi a dosi di 6 e 50 mg/kg. Queste dosi corrispondono rispettivamente a 0,2 e 1,6 volte la dose di mantenimento raccomandata. Inoltre, studi su topi hanno rilevato carcinomi epatocellulari nei maschi a dosi di 100 mg/kg, equivalenti a 1,4 volte la dose di mantenimento raccomandata. Gli adenomi epatocellulari sono stati riscontrati sia nei maschi che nelle femmine dei topi.[1][3]
Note[modifica | modifica wikitesto]
- ^ a b c d e f Health Canada Approved Products: Vfend (voriconazole) multiple forms/routes (PDF), su pdf.hres.ca.
- ^ (EN) Janelle A Sabo e Susan M Abdel-Rahman, Voriconazole: A New Triazole Antifungal, in Annals of Pharmacotherapy, vol. 34, n. 9, 2000-09, pp. 1032–1043, DOI:10.1345/aph.19237. URL consultato il 18 luglio 2023.
- ^ a b c d e f g h i j k VFENDⓇ FDA Label (PDF), su accessdata.fda.gov.
- ^ a b c d e f g Mediately - Dati AIFA su VFEND 200 mg compresse rivestite di voriconazolo, su mediately.co.
- ^ a b c Voriconazole, su go.drugbank.com. URL consultato il 17 luglio 2023.
- ^ J. A. Sabo e S. M. Abdel-Rahman, Voriconazole: a new triazole antifungal, in The Annals of Pharmacotherapy, vol. 34, n. 9, 2000-09, pp. 1032–1043, DOI:10.1345/aph.19237. URL consultato il 18 luglio 2023.
- ^ H. Sanati, P. Belanger e R. Fratti, A new triazole, voriconazole (UK-109,496), blocks sterol biosynthesis in Candida albicans and Candida krusei, in Antimicrobial Agents and Chemotherapy, vol. 41, n. 11, 1997-11, pp. 2492–2496, DOI:10.1128/AAC.41.11.2492. URL consultato il 18 luglio 2023.
- ^ a b c Changcheng Shi, Yubo Xiao e Yong Mao, Voriconazole: A Review of Population Pharmacokinetic Analyses, in Clinical Pharmacokinetics, vol. 58, n. 6, 2019-06, pp. 687–703, DOI:10.1007/s40262-019-00735-7. URL consultato il 18 luglio 2023.
- ^ Romuald Bellmann e Piotr Smuszkiewicz, Pharmacokinetics of antifungal drugs: practical implications for optimized treatment of patients, in Infection, vol. 45, n. 6, 2017-12, pp. 737–779, DOI:10.1007/s15010-017-1042-z. URL consultato il 18 luglio 2023.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Voriconazolo
Wikimedia Commons contiene immagini o altri file su Voriconazolo