Utente:Grasso Luigi/sanbox1/seleniuro
| Seleniuro | |
|---|---|
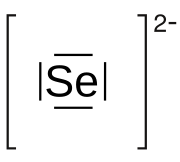 | |
 | |
| Nome IUPAC | |
| Selenio(2-) [1][2] | |
| Abbreviazioni | |
| SE-2 | |
| Nomi alternativi | |
| selandiuro; ione seleniuro; seleniuro(2-) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | S2− |
| Massa molecolare (u) | 78.971[3] |
| Numero CAS | Immagine_3D |
| PubChem | 107674 |
| SMILES | [Se-2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | --- |
| Consigli P | ---[4] |
Un seleniuro è un composto chimico in cui il selenio serve come anione con numero di ossidazione II (Se2−), come succede per lo zolfo in un solfuro. La chimica dei seleniuri corre parallela a quella dei solfuri.
Come per un solfuro, in una soluzione acquosa, lo ione del seleniuro, Se2−, è prevalente soltanto in condizioni basiche. In condizioni neutre, lo ione del seleniuro di idrogeno, HSe−, è il più comune. In condizioni acide si forma il seleniuro di idrogeno, H2Se.
I minerali di seleniuro sono rari e comprendono la ferroselite e l'umangite.[5]
Poliseleniuri
[modifica | modifica wikitesto]Gli anioni poliseleniuri sono catene con la composizione Se2−n. Il termine viene riferito pure ai sali di questi anioni. Sono comunemente sintetizzati dalla fusione di certi elementi in un tubo di quarzo. Il selenio e un metallo alcalino reagiscono inizialmente dando piccole quantità di solidi solubili bianchi come i monoseleniuri. L'eccesso di selenio porta alla formazione di diseleniuri solubili e poliseleniuri molto solubili con l'aumento uniforme di selenio. Alternativamente, possono essere preparati sciogliendo selenio e un metallo alcalino in ammoniaca liquida. [6] La sintesi può anche essere condotta in solventi con alto punto ebollizione, polari, aprotici come DMF, HMPA e NMP.[7]
I poliseleniuri acquosi reagiscono con grandi controioni organici, una reazione detta metatesi del sale, per formare sali cristallini che sono solubili in solventi organici.
- 2 Na + n Se → Na2Sen
- Na2Sen + 2 R4NCl → (R4N)2Sen + 2 NaCl
La loro struttura è stata esaminata tramite cristallografia a raggi X. Una proprietà caratteristica della struttura è che due legami di Se-Se terminali sono più corti di quelli che coinvolgono atomi di selenio interni. La spettroscopia NMR 77Se stato solido ad alta risoluzione per [NMe4]2Se5 ed [NMe4]2Se6 indicano conferme simili degli anioni [Se5]2− e Se2− nel solido e in soluzione. Lo spettro di [NMe4]2Se5 mostra 5 siti di selenio distinti e lo spettro di [NMe4]2Se6 mostra la simmetria con soli 3 siti di selenio cristallograficamente differenti. Lo studio della struttura a raggi-X cristallo-singolo di questi sali conferma i dati della spettroscopia NMR.[8]
Reattività
[modifica | modifica wikitesto]I poliseleniuri sono soggetti a decomposizione per esposizione all'aria, nel qual caso vengono ossidati al selenio elementare.
- Se2−n + 2 H+ + 1/2 O2 → n Se + H2O
I poliseleniuri formano complessi metallici. La funzione Sex (x = 4, 5, 6) indica ligandi chelanti nei complessi, per esempio (C5H5)2TiSe5, analogo al pentasolfuro titanocene.[6] Gli anioni poliseleniuri reagiscono con composti alogeni organici:
- 2 RX + Se2−2 → R2Se2 + 2 X−
Punti quantici di seleniuri metallici
[modifica | modifica wikitesto]
I punti quantici di seleniuri metallici e le nanoparticelle possono essere preparati con una varietà di metodi sintetici disponibili, molti dei quali richiedono alte temperature e composti precursori pericolosi. [9]
Le particelle possono essere adattate per una varietà di applicazioni variando i ligandi coordinati allo strato esterno caricato positivamente. Molte reazioni di scambio di ligandi sono disponibili per l'uso, scambiando ligandi di tipo X, L e Z, il cui meccanismo e' tuttora oggetto di studio.[10]
Applicazioni
[modifica | modifica wikitesto]I punti quantici basati su seleniuri metallici sono studiati estensivamente per le loro peculiari proprietà spettrali.[11]
Le leghe core-shell di solfuro e seleniuro di cadmio sono di interesse per la diagnostica per immagini e la fototerapia.[12]
Note
[modifica | modifica wikitesto]- ^ Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 (Red Book), Cambridge, The Royal Society of Chemistry, 2005, p. 315, ISBN 978-0-85404-438-2.
- ^ pubchem.ncbi.nlm.nih.gov, https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=1693.
- ^ "Atomic weights of the elements 2017" www.chem.qmul.ac.uk.
- ^ Scheda del composto su IFA-GESTIS
- ^ Bernd E. Langner "Selenium and Selenium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a23_525.
- ^ a b Kolis, J. "Coordination Chemistry of Polychalcogen Anions and Transition Metal Carbonyls" Coordination Chemistry Reviews 1990, volume 105, pp. 195-219. DOI: 10.1016/0010-8545(90)80023-M
- ^ Thompson, D.; Boudjouk, P. A. "Convenient Synthesis of Alkali Metal Selenides and Diselenides in Tetrahydrofuran and the Reactivity Differences Exhibited By These Salts Toward Organic Bromides" Journal of Organic Chemistry 1988, volume 53, pp. 2109-2112. DOI: 10.1021/jo00244a051
- ^ Barrie, P. J.; Clark, R. J. H.; Selenium Solid-State NMR Spectroscopy and Structures of Tetramethylammonium Pentaselenide and Hexaselenide Complexes. Inorg. Chem, 1995, 34, 4299–4304 DOI: 10.1021/ic00121a006
- ^ Synthesis of Metal-Selenide Nanocrystals Using Selenium Dioxide as the Selenium Precursor, in Angewandte Chemie International Edition, vol. 47, n. 45, 2008, pp. 8638–8641, DOI:10.1002/anie.200804266.
- ^ Nicholas C. Anderson, Soluble, Chloride-Terminated CdSe Nanocrystals: Ligand Exchange Monitored by 1H and 31P NMR Spectroscopy, in Chemistry of Materials, vol. 25, n. 1, 8 gennaio 2013, pp. 69–76, DOI:10.1021/cm303219a.
- ^ (EN) Daniel R. Larson, Water-Soluble Quantum Dots for Multiphoton Fluorescence Imaging in Vivo, in Science, vol. 300, n. 5624, 30 maggio 2003, pp. 1434–1436, DOI:10.1126/science.1083780.
- ^ Colin M. Hessel, Copper Selenide Nanocrystals for Photothermal Therapy, in Nano Letters, vol. 11, n. 6, 8 giugno 2011, pp. 2560–2566, DOI:10.1021/nl201400z.
Voci correlate
[modifica | modifica wikitesto]- Nanoparticelle
- Seleniuro di gallio(II), GaSe
- Seleniuro di indio(III), I2Se3
- Seleniuro di sodio, Na2Se
Altri progetti
[modifica | modifica wikitesto]
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Selenide Nanoparticles Used In Solar Energy Conversion, su sciencedaily.com.
- (EN) IUPAC Gold Book, "selenides", su goldbook.iupac.org.