Olefinazione di Julia
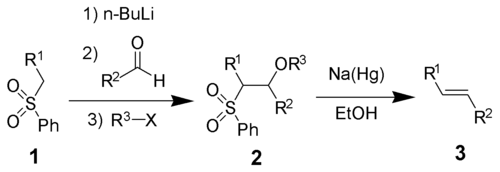
L'olefinazione di Julia è una reazione chimica fra un solfone e un'aldeide (o un chetone) che genera un alchene. La reazione procede attraverso un alcol che funge da intermedio: la successiva eliminazione con una lega contenente sodio e mercurio produce l'alchene. Questa trasformazione è altamente selettiva per la produzione di doppi legami trans.[1]
La reazione prende il nome dal suo scopritore, il chimico francese Marc Julia.
Meccanismo di reazione
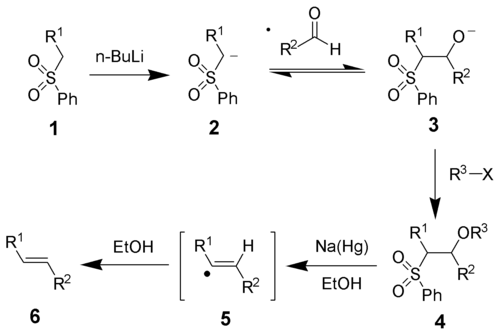
[modifica | modifica wikitesto]Il meccanismo di reazione prevede la deprotonazione del solfone con una base forte. L'anione così generato è stabilizzato dalla presenza di un gruppo aromatico come sostituente sul solfone: successivamente avviene l'attacco sull'aldeide o chetone, che genera l'intermedio. L'eliminazione avviene attraverso un meccanismo radicale che genera il prodotto più stabile, cioè l'olefina trans.
Varianti
[modifica | modifica wikitesto]Nel corso degli anni successivi alla scoperta di questa importante reazione sono state sviluppate numerose varianti che permettono l'utilizzo di reagenti meno tossici della lega di mercurio e sodio e forniscono un maggiore controllo sulla selettività. Una di queste varianti è nota come olefinazione di Julia-Kocienski.[2]
Note
[modifica | modifica wikitesto]- ^ Marc Julia, Jean-Marc Paris, Syntheses a l'aide de sulfones v(+)- methode de synthese generale de doubles liaisons, in Tetrahedron Letters, vol. 14, n. 49, 1973, pp. 4833-4836, DOI:10.1016/S0040-4039(01)87348-2.
- ^ Paul R. Blakemore, William J. Cole, Philip J. Kocieński, Andrew Morley, A Stereoselective Synthesis of trans-1,2-Disubstituted Alkenes Based on the Condensation of Aldehydes with Metallated 1-Phenyl-1H-tetrazol-5-yl Sulfones, in Synlett, vol. 1, 1998, pp. 26-28, DOI:10.1055/s-1998-1570.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Olefinazione di Julia
Wikimedia Commons contiene immagini o altri file su Olefinazione di Julia