Acido perxenico
| Acido perxenico | |
|---|---|
 | |
| Nome IUPAC | |
| acido tetraosso xenico (VIII) | |
| Caratteristiche generali | |
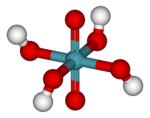
| Formula bruta o molecolare | H4XeO6 |
| Peso formula (u) | 231,32 |
| Numero CAS | |
| Indicazioni di sicurezza | |
| Frasi R | -- |
| Frasi S | -- |
L'acido perxenico è il composto inorganico di formula H4XeO6, dove lo xeno ha numero di ossidazione +8. L'acido perxenico è un acido debole poliprotico che non è mai stato isolato allo stato puro. Si possono invece ottenere alcuni suoi sali, detti perxenati.[1][2]
Sintesi e proprietà[modifica | modifica wikitesto]
Soluzioni diluite di acido perxenico si ottengono acidificando soluzioni di perxenati. L'acido puro non può essere isolato, perché in soluzione acida si decompone rapidamente formando triossido di xeno e ossigeno gassoso:[1][3]
- 2HXeO63– + 6H+ → 2XeO3 + O2 + 4H2O
H4XeO6 risulta un acido debole. Sono stati misurati i seguenti valori delle costanti di dissociazione acida:[3]
- H4XeO6 ⇄ H3XeO6– + H+ pK1 < 0
- H3XeO6– ⇄ H2XeO62– + H+ pK2 = 4,29
- H2XeO62– ⇄ HXeO63– + H+ pK3 = 10,75
- HXeO63–⇄ XeO64– + H+ pK4 > 14
H4XeO6 è un ossidante molto forte in soluzione acida:
- H4XeO6 + 2H+ + 2e– ⇄ XeO3 + 3H2O E° = +2,42 V
mentre in soluzione basica il potenziale di riduzione si abbassa a +0,99 V.[1]
Perxenati[modifica | modifica wikitesto]
I perxenati sono i sali dell'acido perxenico e contengono l'anione XeO64– (ossoanione di XeVIII). Questo anione si forma in soluzione alcalina per disproporzione degli xenati, o per idrolisi di XeF6:[4]
- 2HXeO4– + 2OH– → XeO64– + Xe + O2 + 2H2O
- 2XeF6 + 16OH– → XeO64– + Xe + O2 + 12F– + 8H2O
Alcuni perxenati solidi sono stati isolati. Alcuni esempi sono Na4XeO6•6H2O, Na4XeO6•8H2O e Ba2XeO6•1,5H2O. Questi sali sono solidi incolori, termicamente stabili fino oltre 200 °C. Studi di cristallografia a raggi X e di spettroscopia Raman hanno mostrato che l'anione XeO64– è ottaedrico.[4][5] Gli angoli O–Xe–O sono compresi tra 87° e 93°,[6] e la distanza di legame Xe–O è di 187,5 pm.[7]
Anche l'anione XeO64– è un forte ossidante in soluzione acida, e si riduce a xenato:[2][4]
- 2XeO64– + 6H+ → 2HXeO4– + O2 + H2O
Trattando Na4XeO6 o Ba2XeO6 con acido solforico concentrato si ottiene XeO4.[2]
Note[modifica | modifica wikitesto]
Bibliografia[modifica | modifica wikitesto]
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- W. C. Hamilton, J. A. Ibers e D. R. Mackenzie, Geometry of the Perxenate Ion, in Science, vol. 141, n. 3580, 1963, pp. 532-534, DOI:10.1126/science.141.3580.532. URL consultato il 24 settembre 2012.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- U. K. Klaening e E. H. Appelman, Protolytic properties of perxenic acid, in Inorg. Chem., vol. 27, n. 21, 1988, pp. 3760–3762, DOI:10.1021/ic00294a018. URL consultato il 24 settembre 2012.
- J. G. Malm, H. Selig, J. Jortner e S. A. Rice, The chemistry of xenon, in Chem. Rev., vol. 65, n. 2, 1965, pp. 199-236, DOI:10.1021/cr60234a003. URL consultato il 22 giugno 2010.
- J. L. Peterson, H. H. Claassen e E. H. Appelman, Vibrational spectra and structures of xenate(VI) and perxenate(VIII) ions in aqueous solution, in Inorg. Chem., vol. 9, n. 3, 1970, pp. 619–621, DOI:10.1021/ic50085a037. URL consultato il 24 settembre 2012.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su acido perxenico
Wikimedia Commons contiene immagini o altri file su acido perxenico